|
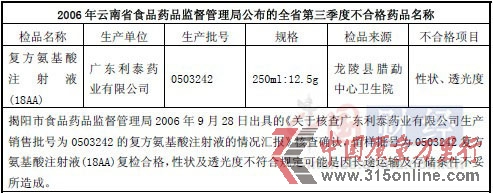
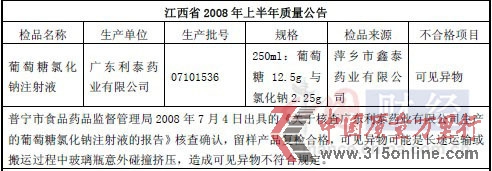
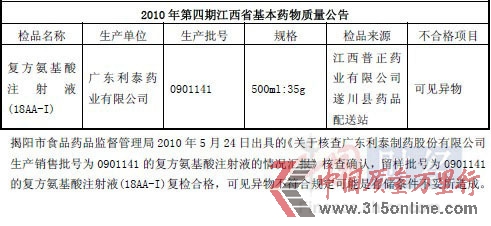
利泰制药多批次产品不合格 经销商曾陷贿赂丑闻时间:2012-03-20 中国网3月20日讯3月19日晚间,广东利泰制药发布招股说明书,公司拟登陆深交所,发行2933.88万股。招股书显示,氨基酸大输液为公司主要销售产品,所占公司业务比重极大。但中国网财经在查阅诸多历史资料后发现,该公司的主营产品——多个批次的氨基酸注射液产品质量不合格,这在相关省份(如江西、河南、广东等)药品检测网站和媒体报道中有据可查,且这种状况从06年就已开始。 06年至今多批次产品被检出不合格 中国网财经查阅历史资料后发现,利泰制药涉及的不合格产品项目可谓“全面开花”,不仅公司的主打产品氨基酸注射液有质量不过关的“劣迹”、氯化钠注射液、葡萄糖等产品均产生过质量问题,有过检测不合格的纪录。 在2006年云南省食品药品监督管理局公布的第三季度不合格药品名单里,利泰制药的生产批号是0503242的复方氨基酸注射液不合格,不合格项目为产品的“性状、透光度”。 而在2008年,江西省各级食品药品监督管理部门对省内药品的检测结果显示,利泰制药的生产批号是07101536的葡萄糖氯化钠注射液检验不合格,检测结果显示,产品不合格的项目为“可见异物”。 而后,质量问题转移到广东省。在2009年,广东省第二季度产品质量公告显示,利泰制药的生产批号是08030542的氯化钠注射液被检测为不合格,检测结果显示,产品不合格的项目为“可见异物”,公司因此遭受了普宁市食品药品监督管理局的处罚。 而翻看利泰制药招股书可发现,公司对此次处罚事件的描述为“该处罚不构成重大违法行为。” 2010年,仍是在江西省,利泰制药的生产批号是0901141的复方氨基酸注射液被检测为质量不合格;检测结果显示,产品不合格的项目仍为“可见异物”。 《中华人民共和国药典》2005年版二部(中国网财经编者注:《中华人民共和国药典》是国家监督管理药品质量的法定技术标准。)明文规定,溶液型静脉用注射液、注射用浓溶液 20支(瓶)供试品中,均不得检出可见异物。对于产品检测“可见异物”的解释,中国网在查阅相关医药资料后了解到,近年来,注射剂抽验中可见异物不合格率持续居于高位;在此类药品中,如果在制造过程中混有可见异物,就会影响公众的用药安全,如若违规使用此类药物,会产生副作用如过敏反应、微循环障碍、血管栓塞等,严重时危及患者生命,也会给企业带来不良影响。 对于屡次出现主要产品质量问题,利泰制药在招股书提出“严格控制原辅材料质量、选用高品质的药品包装材料、对生产环节的质量控制、建立产品入库前检验制度、改善外包装材料、加强储存管理,协调经销商加强销售环节的运输、储存管理”等解决方案。 两大经销商曾深陷商业贿赂丑闻 另外,中国网财经还发现,利泰制药的经销商河南新明辉医药有限公司、河南省柏海同心医药有限公司曾经陷入商业贿赂事件,并因此被河南省卫生厅列入黑名单。 资料显示,2007年底,有30多家药品生产、经营企业在河南省一些医院的个别科室搞药品临床促销,给予对方回扣,其中就包括了利泰制药的经销商河南新明辉医药有限公司、河南省柏海同心医药有限公司。利泰制药对以上两家经销商销售复方氨基酸(18AA-Ⅳ)麦克灵大输液情况如下: |